開発関連職 (開発・臨床薬理・統計解析・データマネジメント・ファーマコビジランス)の仕事
どんな仕事?
開発部門は言葉のイメージから、研究部門と混同されがちですが、自ら実験することはありません。
新薬発売までの最終ステージである臨床試験を中心となって進めることが主な役割。
臨床試験の計画立案から実施、データの解析、申請などの多岐にわたる業務を、プロジェクトチームを組んで行います。

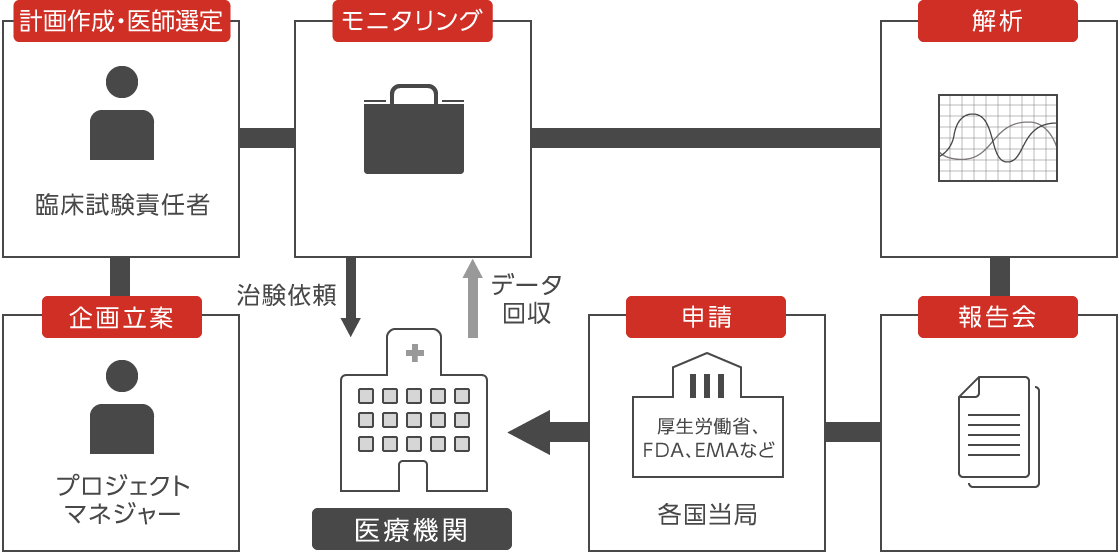
どんな業務内容?
社内外の関係者と連携しながら、迅速・確実な医療品開発を実施します。
-
臨床試験を中心となって進めるのが、開発職。試験が計画書に沿って正しく実施されているのかモニタリングすることが主な業務です。具体的には、治験実施医療機関および治験責任医師の要件調査・選定、治験実施計画書などの説明、契約手続き、治験薬の搬入、治験実施状況の確認、症例報告書の入手、記載内容の確認、治験薬の回収などを行います。
モニターとして開発の基礎を身につけた後は、プロジェクトマネジャー、臨床試験責任者、データマネジメント、CROマネジメント、薬事といった開発プロジェクトに関する企画・管理部門へキャリアステップします。 -
シオノギで行うすべての臨床試験(グローバル試験を含む)のデータマネジメント業務を行っています。データマネジメント業務は、統計解析しやすいデータの提供を目的としています。そのために、国内外/社内外の関係者と折衝・連携して、臨床データを収集する症例報告書を設計し、入力されたデータに不整合がないかの確認、医療機関への問い合わせ等を行っています。また、より効率的にデータ収集を行うために最適なIT技術の導入や運用、収集したデータを活用することにも取り組んでいます。
-
統計学的な観点から最適な臨床試験のデザインを提案、適用し、臨床試験の効率化、申請パッケージの最適化、探索解析を通じて新薬の早期上市や価値最大化に貢献します。例えば臨床試験の計画時においては、医薬品以外にも治療効果に影響する要因があることを踏まえ、臨床試験で医薬品の効果を正しく評価するために、それらの要因をどのように扱うか、効果を確かめるには何名の方が必要か、試験データをどのように解析するか等を検討します。
-
臨床薬理部門ではヒトでの有効かつ安全な用法・用量を設定することを目的に、臨床試験で得られた健康な被験者あるいは患者さまにおける薬物濃度データを用いて、薬物動態(Pharmacokinetics、PK)解析ならびに薬効(Pharmacodynamics、PD)解析を行い評価しています。臨床試験に関する業務の他に、前臨床段階では動物PKデータからヒト体内動態パラメータを予測したり、市販後はTDMソフトウェアを作成し、MR活動を支援したりもします。
-
開発薬事職は、開発プロジェクトや社内各部署、およびPMDAやFDA、EMAといった各国の規制当局とコミュニケーションを密にとりながら合理的な申請戦略を策定します。また、開発関連文書,承認申請資料を迅速且つ正確に作成するメディカルライティング業務を行い新薬の承認に貢献します。
-
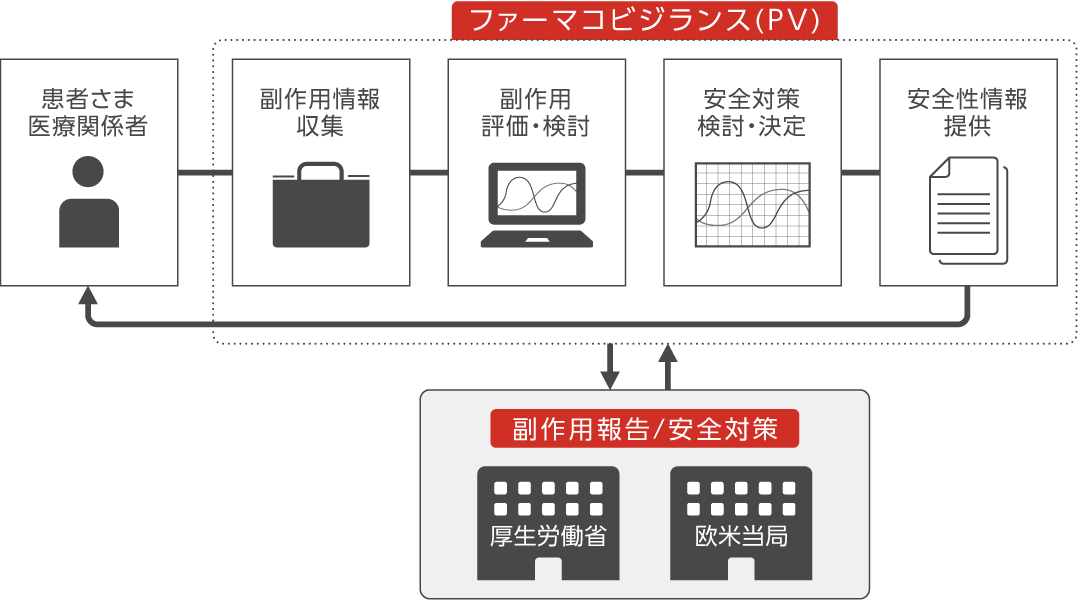
医薬品は、病気で苦しんでいる患者さまを助けるために使われます。その一方で、副作用が患者さまを苦しめてしまうこともあります。副作用を中心とした、医薬品の安全性に関する情報(安全性情報)を集め、適切に対策を講じることによって、副作用の発生を最小限にとどめ、患者さまに安心して使っていただく環境を築くことが、ファーマコビジランスの仕事です。
【主な業務内容】
・開発部門と協力し、臨床試験の段階から、薬剤の安全性を評価
・MRと協力し、市販後における副作用情報を収集・検討
・常に新しい安全性情報を提供するために、適切に添付文書を改訂
・マーケティング部門と協力し、医療機関や患者さま向けのパンフレット作成
・市販後における安全性と有効性を確認するために、製造販売後調査を立案・実施
・集まった情報をまとめ、定期的に厚生労働省および欧米当局に報告
・海外で開発・販売されている薬剤においては、グローバル企業、関係子会社と情報共有し、安全性を評価※塩野義製薬株式会社安全管理部と、シオノギファーマコビジランスセンター株式会社が協力しながらシオノギのファーマコビジランス活動を推進しています。
〒541-0045
大阪市中央区道修町3丁目1番8号
Copyright ©SHIONOGI & CO., LTD. All right reserved.



